胡建明,张雅婷,周英,刘浩,李璇,杜光辉,刘飞虎,**
(1.云南大学 资源植物研究院,云南 昆明 650091;
2.云南大学 生命科学学院,云南 昆明 650091;
3.云南省西双版纳傣族自治州农业科学研究所,云南 景洪 666100)
近几十年来,中国工业化进程明显加快,城市规模迅速扩张,引发的土壤重金属污染问题日益严峻[1].据调查显示,中国约有2.0×107hm2的耕地受到重金属污染[2],每年受到土壤重金属污染影响的农作物约有1.2×107t[3],严重危害中国粮食生产安全.铅是主要的重金属之一,土壤中高水平的铅等重金属污染不仅会影响植物的正常生长,而且可能通过食物链传递进入人体[4],引发各种高风险疾病和癌症,危害人类健康.土壤重金属污染直接影响食品及环境安全,因而引起了社会各界的广泛关注.
重金属污染土壤的植物修复技术一直是国内外环境治理的研究热点,而如何有效活化土壤中的重金属是植物修复技术的关键[5].螯合剂是一种多齿配体,其配体如氧(―OH,―COO,―POO)、氮(―NH2,―NH)或硫(―SH,―S―S)等可以与单个金属离子结合[6],螯合剂与金属离子结合后会形成多齿金属配合物,称为螯合物.螯合物极易溶于水,阻碍了金属的沉淀和吸附,从而增加了植物对金属离子的吸收作用.研究表明,在土壤中施入螯合剂,可以使重金属离子变为易于植物吸收的有效态,增加植物的吸收和积累量[7-9],最终达到降低土壤中重金属含量的目的.不同种类和浓度的螯合剂对植物吸收重金属的促进效果不同,且螯合剂可能对植物本身和环境造成危害,所以筛选出合适的螯合剂及施加浓度来辅助植物吸收土壤重金属具有重要的研究意义和潜在应用价值.
大麻(Cannabis sativaL.)是大麻科大麻属的一年生草本植物,其根系发达、生物量大、抗逆性强、生长速度快且生育周期短[10],对重金属具有较强的耐性和富集能力,因此它是一种理想的用于修复重金属污染土壤的备选作物[11-12].有研究表明,在铅污染为1 100 mg·kg-1的土壤中施加螯合剂可以提高大麻对重金属铅的积累量[13].然而,本实验室的研究发现,大麻在铅质量比2 000 mg·kg-1条件下仍能进行正常生长[14].本文基于本实验室的前期试验结果,选取对重金属铅敏感且对螯合剂耐性较强的大麻品种巴马火麻为试验材料[14],通过盆栽试验,在基质中添加2 000 mg·kg-1的Pb(NO3)2模拟土壤重金属铅污染,比较该胁迫程度下施加螯合剂EDTA 或CA 对大麻生长及吸收、转运和富集重金属铅能力的影响,旨在为螯合剂辅助植物修复土壤重金属污染提供参考依据.
1.1 试验材料供试大麻品种为巴马火麻(BM),由广西农业科学院经济作物研究所提供;
Pb(NO3)2、螯合剂乙二胺四乙酸二钠(EDTA-2Na,简写为EDTA)和柠檬酸(CA)均为分析纯试剂,购自西陇科学股份有限公司(Lot No.1609031).称取一定质量的螯合剂溶于水中,定容至1 L,配置成不同浓度的螯合剂溶液(0、2、5、10、15 mmol·L-1)供试基质为挪威JIFFY 公司生产的泥炭基质,其基本化学组成(mg·kg-1):全氮5 200、水解氮292、全磷760、有效磷338、全钾1 780、速效钾859、总铅168.5、有效铅103.5,pH=5.6.
1.2 试验方法采用盆栽试验,用直径40 cm、高26 cm 带有托盘的塑料花盆,先每盆装商用泥炭3.5 kg 并施加15 g 复合肥m(N)∶m(P2O5)∶m(K2O)=24∶10∶14)作为底肥,然后基于前期试验结果,向泥炭基质中添加2 000 mg·kg-1的Pb(NO3)2,搅拌均匀,静置平衡2周,期间每隔5 d 浇500 mL 水湿润基质,促进基质与重金属络合.
每盆播种30 粒精选的大麻种子,待幼苗长至3 对真叶时进行间苗,每盆留下长势均匀的幼苗8 株.间苗后2 d 开始施加螯合剂乙二胺四乙酸二钠(EDTA)或柠檬酸(CA),浓度均为0(CK)、2、5、10 mmol·L-1和15 mmol·L-1,每个处理设3 次重复.每次每盆施螯合剂溶液500 mL(静置自来水配制),共浇施4次,间隔1 周.根据基质湿度进行定量浇水,保持基质含水量为最大田间持水量的70%~80%.
1.3 测定指标及方法
1.3.1 大麻株高、茎粗和生物量的测定 最后一次浇施螯合剂1 周后收获植株,使用卷尺和游标卡尺测量所有大麻植株的株高和茎粗.之后将根、茎、叶分别采收,装入不同纸袋.地上部分(茎、叶)108 ℃下杀青20 min,80 ℃条件下烘干;
地下部分清水洗净后,用滤纸吸去根表水分,80 ℃烘干.
1.3.2 基质中总铅、有效态铅质量比和大麻植株中总铅质量比的测定 将试验后各处理的基质分别收集,经风干、粉碎、过筛后交由专业单位测定基质的总铅有效态铅质量比(mg·kg-1).取1.3.1烘干的根、茎、叶样品,经粉碎、过筛后交由专业单位测定大麻根、茎、叶中铅质量比(mg·kg-1).大麻植株铅含量的测定方法参照《食品安全国家标准-食品中铅的测定》(GB 5009.12—2017)标准进行测定;
基质总铅含量的测定方法参照《固体废物-金属元素的测定电感耦合等离子体质谱法》(HJ 766—2015)标准进行测定;
基质有效态铅含量的测定方法参照《土壤8 种有效态元素的测定二乙烯三胺五乙酸浸提-电感耦合等离子体发射光谱法》(HJ 804—2016)标准进行测定。
1.4 重金属铅吸收量、富集系数及转移系数计算方法根据大麻对重金属铅的富集系数和转移系数评价螯合剂处理下大麻对重金属铅的富集能力,计算方法如下[15]:
铅积累量(μg/株)=植物地上部(地下部)铅质量分数×植物地上部(地下部)干重;
富集系数=植物地上部分(地下部分)铅质量分数/基质中总铅质量分数;
转移系数=植物地上部铅质量分数/植物地下部铅质量分数.
1.5 数据处理与分析各处理和各项指标测定均设置3 次生物学重复,利用Microsoft Excel 2010 整理所收集到的试验数据、建立数据表并作图;
使用IBM SPSS Statistics 25.0 进行数据单因素方差分析和LSD 进行处理间多重比较(P<0.05).
2.1 螯合剂对重金属铅的活化效果由图1 可知,两种螯合剂均能显著(P<0.05,下同)提高基质中的有效态铅质量比.随着EDTA 和CA 浓度的增加,基质有效铅质量比逐渐上升,并在浓度15 mmol·L-1时有效铅质量比达到最大值,分别为1 233.33、1 190.33 mg·kg-1,是CK 的1.96 和1.90 倍.施 加2 mmol·L-1的EDTA 和CA时,基质有效铅质量比较CK 相比,分别增加了30.50%和26.58%;
在相同浓度条件时,CA 处理下的基质有效铅含量均低于EDTA 处理.由此可见,施加两种螯合剂都能在一定程度上提高基质有效铅质量比(活化重金属),且EDTA 活化铅的效果更好.
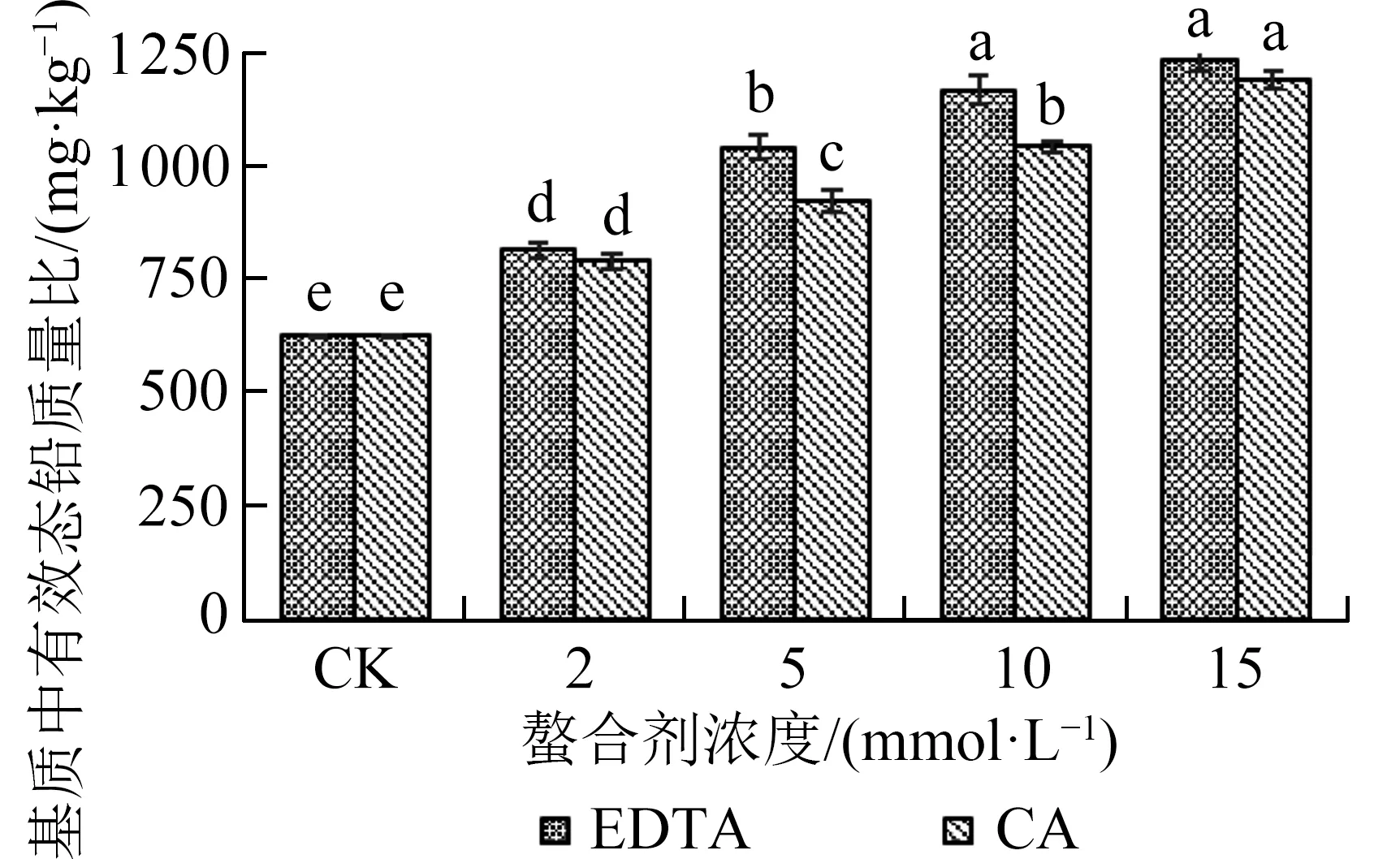
图1 不同螯合剂及其浓度对基质中有效态铅质量比的影响Fig.1 Effects of different chelators and their concentrations on the content of available Pb in the cultivation substrate
2.2 螯合剂对大麻吸收铅的影响与CK 相比,施加螯合剂使大麻根部、茎部和叶部的铅质量比呈显著性增加,且根部的铅质量比总是高于同浓度处理下的茎部和叶部.大麻根、茎、叶的铅质量比随EDTA 和CA 浓度的增加均呈现先升后降的趋势.不同的是,在EDTA 浓度为5 mmol·L-1时,大麻的根、茎、叶对重金属铅吸收量达到最大值,分别为428.8、307.7 mg·kg-1和287.4 mg·kg-1,是CK 的5.25、7.86 和11.59倍,此后随着EDTA 浓度的升高,大麻对重金属铅的吸收量显著降低;
CA 在10 mmol·L-1浓度处理下时大麻根、茎、叶铅吸收量最高,分别为378.1、262.5 mg·kg-1和210.1 mg·kg-1,是CK 的4.63、6.71 和8.47 倍.此外,低浓度(≤5 mmol·L-1,下同)EDTA 处理时大麻对铅的吸收量高于CA,但高浓度(≥10 mmol·L-1,下同)EDTA 处理时,大麻对铅的吸收量显著降低,低于同浓度CA 处理(图2).
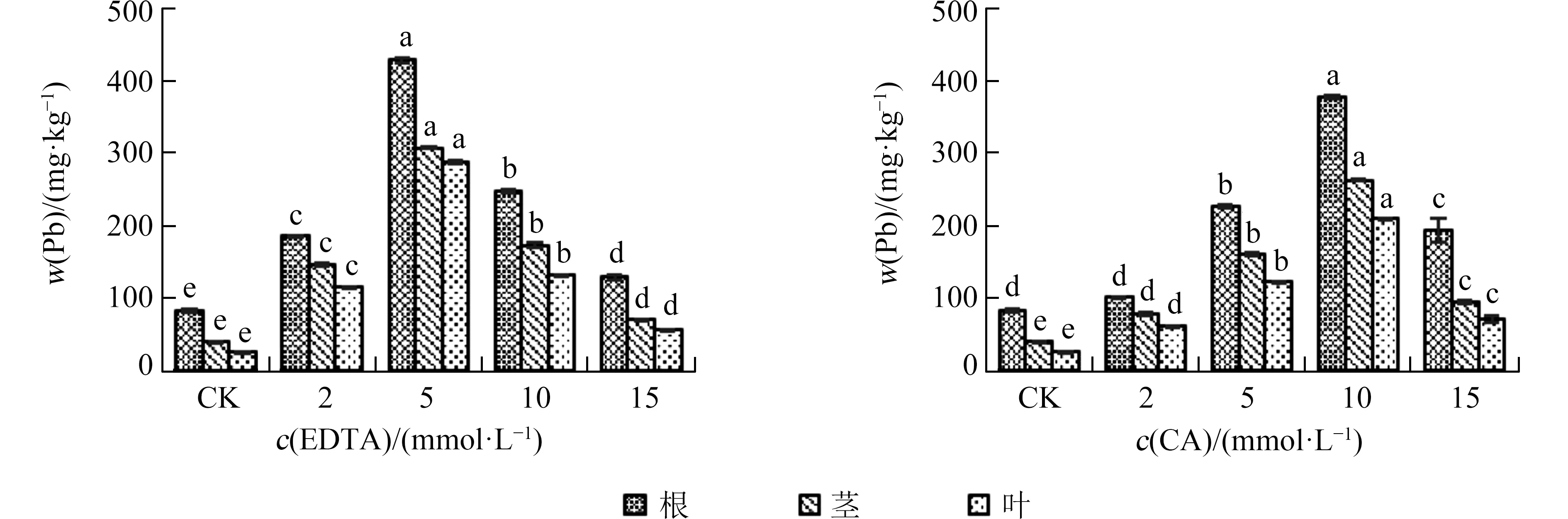
图2 不同螯合剂及其浓度对大麻植株铅质量比的影响Fig.2 Effects of different chelators and their concentrations on Pb content in hemp plants
植株铅吸收量随基质有效态铅质量比的增加呈现先上升后下降的趋势,且在基质有效铅质量比为1 043 mg·kg-1时达到最大(图3).EDTA 处理下植株铅吸收量最大值为363.15 mg·kg-1,CA 处理下为307.19 mg·kg-1,此时分别是CK 的6.39 和5.41倍.当基质中有效铅质量比大于1 043 mg·kg-1后,植株铅质量比急剧下降.由此可见,EDTA 螯合铅的能力较CA强,且在一定条件下大麻对铅有较强的富集能力.
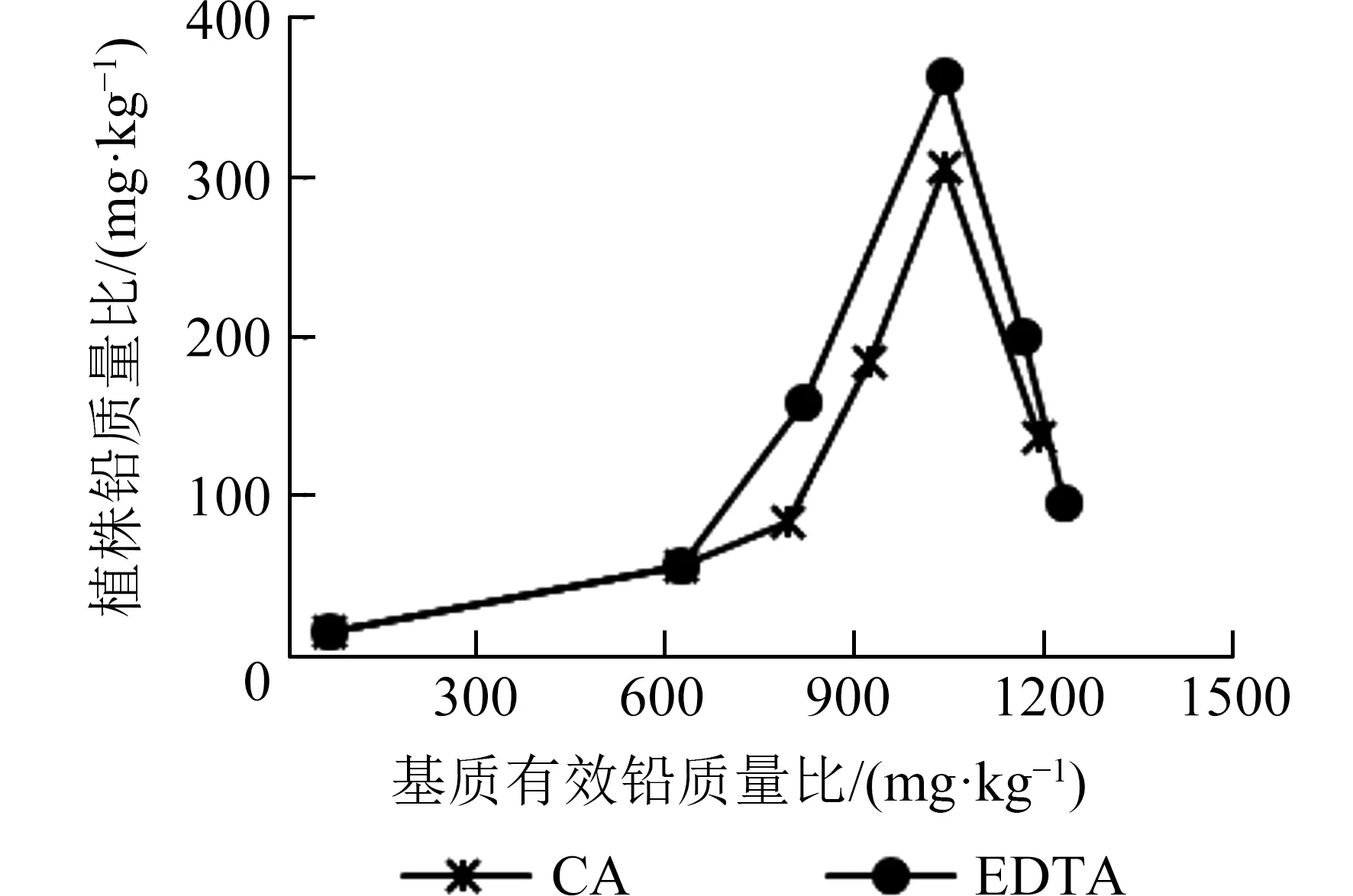
图3 不同螯合剂处理下基质有效态铅质量比与大麻植株铅质量比的关系Fig.3 The relationship between the available Pb content in the substrate and the Pb content in hemp plants under treatments of different chelators
2.3 螯合剂对重金属铅污染基质中大麻生长的影响表1 为施加不同浓度螯合剂对大麻株高、茎粗、生物量的影响.从表1 中可知,大麻株高、茎粗和生物量随EDTA 和CA 浓度的升高均呈现先升后降的趋势.在浓度为2 mmol·L-1时大麻的株高、茎粗和生物量达到最大,此时EDTA 处理下相比于CK 分别增加了0.27%、2.53%和5.85%,而CA相比于CK 分别增加了1.87%、7.43%和15.17%.可见在铅胁迫环境下施加低浓度螯合剂可以缓解重金属铅对植株生长所造成的伤害,此外,相同浓度条件下,CA 处理组大麻株高、茎粗和生物量均高于EDTA 处理,说明CA 的缓解作用强于EDTA.
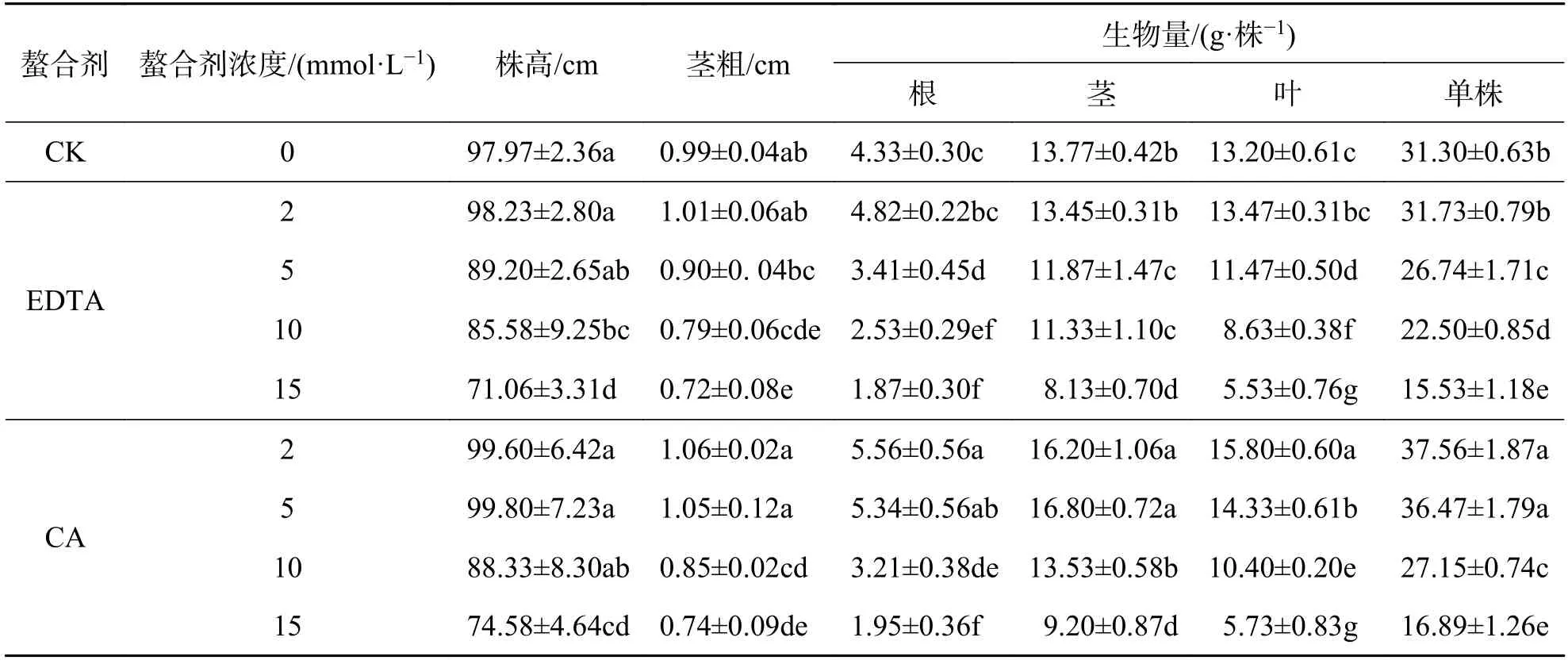
表1 不同螯合剂及其浓度对大麻株高、茎粗和生物量的影响Tab.1 Effects of different chelators and their concentrations on the plant height,stem diameter and biomass of hemp
2.4 螯合剂对大麻积累重金属铅的影响如图4所示,大麻根、茎、叶的铅积累量随螯合剂浓度的增加均呈先升高后降低的趋势,且茎部的积累量总是高于同处理的根部和叶部.在EDTA 为5 mmol·L-1时,大麻根、茎、叶的铅积累量达到最大值,分别为1 460.8、3 655.4 μg/株和3 295.9 μg/株,是CK 的4.21、7.12、10.56 倍;
CA 处理下,大麻对重金属铅的最大积累量出现在CA 浓度为10 mmol·L-1时,分别为1 222.4、3 553.2 μg/株和2 183.6 μg/株,是CK 的3.36、6.23、6.36 倍.此外,低浓度EDTA 处理下大麻铅积累量高于CA,但高浓度EDTA 处理下,大麻铅积累量显著降低,低于同浓度CA 处理.
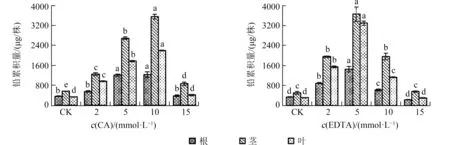
图4 不同螯合剂及其浓度对大麻植株铅积累量的影响Fig.4 Effects of different chelators and their concentrations on Pb accumulation in hemp plants
2.5 螯合剂对大麻富集和转运铅能力的影响由表2 可知,大麻地上部分、地下部分以及单株富集系数随螯合剂浓度增加均呈先上升后下降的趋势,而且地下部分富集系数高于地上部分.在EDTA 浓度为5 mmol·L-1时,大麻的地下部、地上部及单株富集系数均达到最大,分别为0.214、0.149 和0.171,是CK的5.25、9.30 和7.03 倍;
在CA 浓度为10 mmol·L-1时,大麻的相应参数达到最大,分别为0.189、0.118和0.142,是CK 的4.63、7.39 和5.84 倍.施加浓度为2 mmol·L-1的EDTA 和CA时,大麻的转运系数达到最大,较CK 分别提高了79.16%和75.11%.此外,相同浓度条件下,EDTA处理组大麻转运系数高于CA.因此,适当施加两种螯合剂均可以提高大麻对铅的富集能力和铅从根部向地上部转移的能力,且EDTA 的强化效果较CA 更好一些.
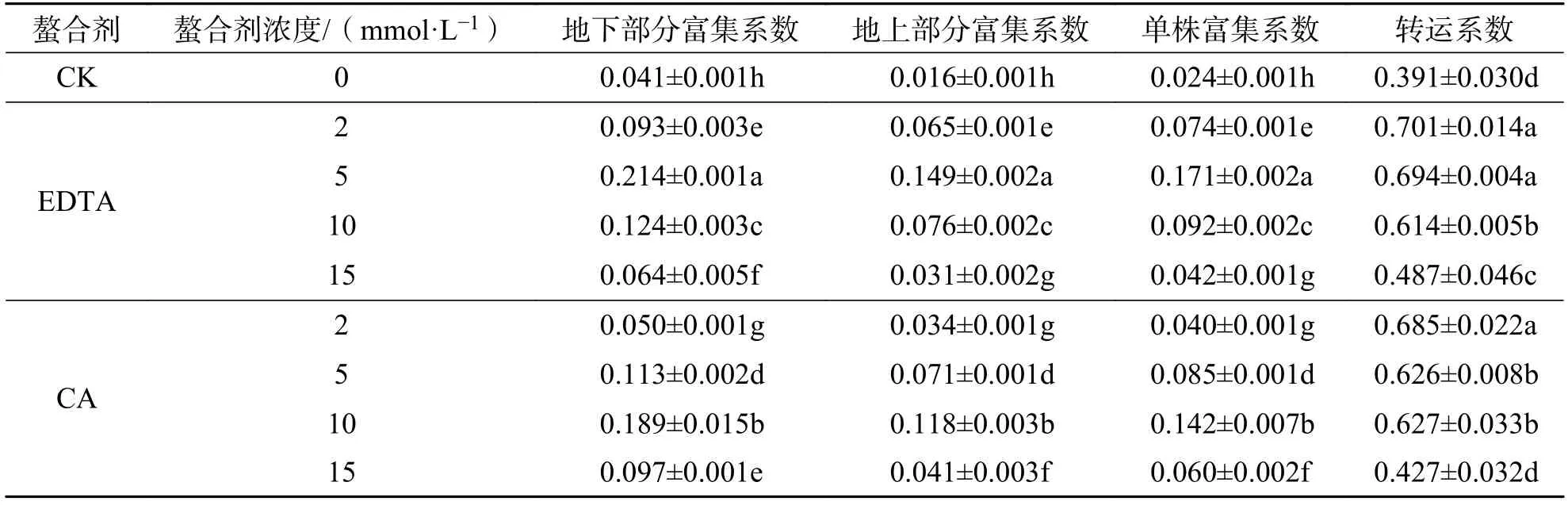
表2 不同螯合剂及浓度对大麻铅富集系数与转运系数的影响Tab.2 Effects of different chelators and their concentrations on Pb enrichment coefficient and transport coefficient of hemp
土壤中的铅具有稳定[16]、易积累和不可逆等特性[17],植物过量吸收会对植物的生理生长产生毒害.重金属在土壤中与土壤的固相部分结合紧密,导致其很难被植物吸收利用.螯合剂是含有多齿配体的高分子化合物,其配体可以和单个金属离子结合,从而打破重金属离子与土壤固相的结合,增加土壤中重金属离子浓度,提高重金属离子的生物有效性,促进植物对金属离子的吸收作用[18].本试验中,在铅胁迫环境下施加不同浓度(0、2、5、10 mmol·L-1和15 mmol·L-1)、不同种类(EDTA 和CA)的螯合剂,发现不同螯合剂在提高基质有效态铅方面均能发挥较好的效果.结合2 种螯合剂对大麻吸收重金属铅的影响来看,发现低浓度的EDTA处理下大麻对重金属铅的吸收量高于CA 处理,但高浓度的EDTA 处理下,大麻对重金属铅的富集量显著降低,低于同浓度CA 处理.造成这一现象的原因可能是EDTA 作为一种氨基多羧酸,螯合铅的能力较强,但具有一定的生物毒性[19],因此低浓度EDTA 促进植株吸收重金属效果显著,但浓度过高时会对大麻的生长生理过程产生的较大的影响,导致大麻富集能力降低.CA 是一种天然小分子有机酸,螯合铅的能力较EDTA 稍弱,但对植物毒性较小甚至能在一定程度上减轻重金属对植物的毒害作用[20-21],其在基质中除了发挥螯合作用之外,还能降低基质pH,增强基质中微生物的活性[8],进而促进大麻对铅的吸收.因此,在高浓度螯合剂处理下,CA 促进大麻吸收铅效果较EDTA 好.植株铅含量随基质有效态铅含量的增加先缓慢上升随后急剧下降,分析其中原因可能是因为低浓度螯合剂和低浓度重金属铅都可以促进植物生长[22],而当螯合剂或重金属铅浓度超过一定阈值后都会使植株生长严重受阻[23],甚至破坏细胞结构[24],最终抑制植株对铅的吸收.基质中有效态铅质量比随螯合剂浓度的增加而增加,这与陈雅慧等[25]的研究结论一致.在本试验中,施加15 mmol·L-1EDTA 和CA 时基质有效态铅质量比达到最大,施加更高浓度的螯合剂能否继续有效活化基质中的铅有待进一步研究.
大麻不同部位的铅质量比大小为根>茎>叶(图2),但由于大麻根部生物量较低,因此根部铅积累量并不高,且在高浓度螯合剂处理下根部生长受抑制严重,该现象尤为明显.由于植物的根数、根长和根表面积在重金属胁迫下会严重减少[26],分析大麻根部生长受到抑制的原因之一是螯合剂促使大量重金属铅通过根系进入植株体内,造成根部细胞受损严重.研究发现,经EDTA 处理后,尽管玉米根系铅含量是地上部的5.48倍,但根中的铅积累量因生物量小而远远低于地上部分[27].此外,本试验结论是在盆栽条件下获得的,也有可能是盆栽环境限制了大麻生长,阻碍了大麻根系的伸展,减少了其对重金属铅的吸收、积累,其结果还有待于大田微区试验进一步验证.
低浓度螯合剂处理可促进大麻生长使大麻株高、茎粗和生物量有所上升,其原因可能是低浓度的螯合剂可在一定程度上缓解重金属对植物造成的抑制作用,从而使生物量有所增加[15].本试验中,高浓度的螯合剂导致大麻的株高、茎粗和生物量降低,这与大部分学者研究得出的“高浓度螯合剂会导致植物生长受到抑制”结论相符[28-29].分析其中原因可能有两个:一是高浓度的螯合剂作为胁迫因子破坏了植株的细胞结构,导致植株生长受到抑制.另一可能是高浓度螯合剂增加了大麻对重金属铅的吸收,铅在植物体内传递的过程中破坏了正常的离子调控转运机制和细胞质膜,使大麻体内积累了较多的重金属,从而导致植株的生长受到抑制.在浓度相同时,CA 处理组大麻株高、茎粗和生物量均高于EDTA 处理,这同马叶等[30]的研究结论一致,其原因是EDTA 作为一种人工螯合剂,对植株和土壤产生毒性影响[31];
而CA 是植物生长自身合成的有机酸,在低浓度时可改善土壤环境有利植物生长[20-21].
植物的生物量和富集系数是衡量植物是否具有重金属修复潜力的关键.本试验中,施加低浓度的螯合剂可以促进植株生长和提高大麻对重金属铅的富集系数,并且根部富集系数总是显著高于地上部分.结合螯合剂对大麻铅转运系数的影响来看,根部富集的铅向地上部转移并不充分,表明大麻将重金属铅由根部转移到地上部的效率有限,根部成为了大麻富集铅的主要器官,国内部分学者在黑麦草和蚕豆的相关研究中也得出类似的结论[32-33].此外,当螯合剂浓度为2 mmol·L-1时转运系数最大,而富集系数在5 mmol·L-1EDTA 和10 mmol·L-1CA 处理时最大.这可能是由于在高浓度螯合剂处理时,基质中活化的铅浓度过高,大量铅富集在根部并产生毒性,导致铅向地上部转运受阻[34],从而使转运系数表现下降.
综上所述,在铅添加量为2 000 mg·kg-1的泥炭盆栽条件下,施加适宜浓度的螯合剂不仅可以缓解重金属铅对大麻生长产生的毒害,而且提高了大麻对铅的吸收和转运能力,增强了大麻对铅污染基质的修复效果,为铅污染土地的植物修复提供了有效的策略.
施加EDTA 或CA 均能显著提高基质中的有效态铅质量比,且EDTA 提高基质有效态铅效果较CA 好.在铅胁迫条件下施加低浓度的螯合剂可以在一定程度上缓解铅对植株生长所造成的伤害,而高浓度螯合剂会导致植物生长受阻;
适当施加螯合剂有助于大麻对铅的吸收与积累、增强大麻对铅的富集能力和铅由地下部向地上部转移的能力.综合大麻对铅的吸收和大麻生长(生物量)来看,施加5 mmol·L-1EDTA 或10 mmol·L-1CA 时大麻对铅污染基质的修复效果最佳.