叶婷,杨康,王田甜,廖玉娇,杜文倩,黄敏,蒋佩文,李敏惠,杨平
1.成都医学院基础医学院,四川 成都 610500;
2.成都医学院科研实验中心,四川 成都 610500;
3.成都医学院生物科学与技术学院,四川 成都 610500;
4.成都医学院药学院,四川 成都 610500;
5.成都医学院教务处,四川 成都 610500
鸟苷酸结合蛋白(guanylate binding protein,GBP)是干扰素刺激基因(interferon stimulate gene,ISG)之一[1]。人 GBP 家族有 7 个成员:GBP1 ~ 7,具有多种生物学功能[2]。研究显示,GBP5 在病原菌引起的炎症反应中起重要作用[3]。感染后,机体可通过调控GBP5的表达,激活Caspase-1/11依赖的细胞炎性反应,启动抗感染固有免疫应答[4-6]。同时,GBP5 还具有广谱的抗病毒能力。甲型流感病毒感染宿主细胞后,机体可通过激活转录因子NF-κB调控GBP5启动子活性,诱导GBP5表达进而发挥其抗病毒生物学效应[7]。基因的表达是一个涵盖mRNA 转录、转录后修饰、蛋白质翻译等的复杂过程,而转录因子的调控机制是其中重要环节。目前关于GBP5启动子核心区域的定位和相关转录因子的调控机制尚不清晰。基于此,本研究通过构建人GBP5启动子荧光素酶报告基因质粒,确定GBP5启动子核心区域,筛选出可能调控其启动子活性的转录因子,为进一步探究GBP5的生物学功能奠定理论基础。
1.1 细胞及质粒 人胚胎肾上皮细胞293FT 购自美国 Invitrogen 公司;
质粒 pGL3-Basic、pGL3-Control 及海肾荧光素酶质粒pRL-CMV 购自美国Promega 公司;
pIRES2-EGFP质粒购自南京擎科生物公司。
1.2 主要试剂及仪器 胎牛血清、Opti-MEM 培养基、DMEM 基础培养基购自美国Gibco 公司;
细胞基因组DNA 提取试剂盒、琼脂糖凝胶回收试剂盒、无内毒素小剂量质粒DNA 提取试剂盒、细胞总RNA 提取试剂盒购自天根生化科技(北京)有限公司;
LipoD293 转染试剂购自美国SignaGen 公司;
E.coliDH5α、氨苄青霉素购自生工生物工程(上海)股份有限公司;
PCR 反转录及扩增试剂盒、DL15000 和DL2000 DNA marker、限制性内切酶HindⅢ、BamHⅠ和XhoⅠ以及T4 DNA Ligase 购自日本TaKaRa公司;
双荧光素酶检测试剂盒购自美国Promega公司;
蛋白提取裂解液、蛋白酶抑制剂、BCA 蛋白定量试剂盒购自中国Transgene公司;
兔抗人GBP5、GAPDH单克隆抗体以及HRP 标记的山羊抗兔IgG 购自美国CST 公司;
PVDF 膜、ECL 显色液购自美国 Millipore 公司;
Universal ProbeLibrary Set(Human Probes#1-#90)(Cat.No.04683633001)购自美国Roche 公司;
全波长酶标仪(VICTOR-X)购自美国PerkinEImer 公司;
实时定量PCR仪(CFX96)购自美国Bio-Rad公司。
1.3 生物信息学分析 通过NCBI数据库查询获得人GBP5(ID:115362)基因组全长序列,选取GBP5基因5′UTR区域上游2 042 bp(-1 995 ~ +47 bp)启动子序列,利用在线网站JASPAR(http://jaspar.genereg.net/)对GBP5启动子区域转录因子结合位点进行预测分析。
1.4 目的基因序列的扩增 使用Primer 5 软件设计引物,引物序列见表1,引物由南京擎科生物科技有限公司合成。以提取的293FT细胞基因组DNA为模板,PCR 扩增获得不同长度的GBP5启动子片段和YY1基因序列,用凝胶回收试剂盒纯化扩增产物。

表1 GBP5不同启动子片段PCR引物信息Tab.1 Primer sequences of different promoter fragments of GBP5 for PCR
1.5 人GBP5启动子序列重组质粒的构建 利用限制性内切酶HindⅢ和XhoⅠ对pGL3-basic 质粒和目的序列进行双酶切,用T4 连接酶将目的序列与质粒DNA 按摩尔比5∶1 16 ℃连接过夜,连接产物转化E.coliDH5α,涂布含 100 μg/mL 氨苄青霉素的LB 琼脂平板,37 ℃恒温培养箱倒置培养16 h;
挑取单个阳性克隆进行菌落PCR 鉴定。将鉴定正确的质粒转至含100 μg/mL 氨苄青霉素的液体培养基中,37 ℃摇菌12 h;
用无内毒素质粒DNA 提取试剂盒提取质粒,并送至南京擎科生物科技有限公司测序。
1.6YY1过表达质粒的构建 用限制性内切酶HindⅢ和XhoⅠ双酶切目的基因和pIRES2-EGFP 质粒,用T4 DNA 连接酶连接构建YY1过表达质粒pIRES2-EGFP-YY1,方法同1.5项,经菌落PCR及双酶切鉴定后,提取质粒备用。
1.7 细胞转染 采用LipoD293 试剂,具体方法参考试剂说明书进行。提前18 ~24 h 将对数生长期的293FT 细胞接种至96孔板中,2×104个/孔,转染前30 ~60 min 更换新鲜的完全培养基。每组设3 个重复孔,按10∶1 的比例共转染各重组质粒和内参质粒pRL-CMV,同时设阳性对照和阴性对照组,分别以相同的转染比例共转染包含SV40 启动子和增强子序列的阳性对照质粒pGL3-Control 和缺少真核启动子和增强子序列的阴性对照质粒pGL3-Basic。
提前18 ~24 h 将对数生长期的293FT 细胞接种至12孔板中,3×105个/孔,转染前30 ~60 min更换为新鲜的完全培养基,用LipoD293 试剂将YY1过表达质粒转染至293FT 细胞,设转染pIRES2-EGFP 空载体质粒的对照组,48 h 后观察荧光表达情况。RT-qPCR 法检测过表达质粒转染后细胞中YY1mRNA转录水平。使用Roche 在线网站(roche.com)设计引物,引物序列见表2,引物由南京擎科生物科技有限公司合成。采用Taqman探针法,进行qPCR。反应条件为:95 ℃ 10 min;
95 ℃ 10 s,60 ℃ 30 s,72 ℃ 10 s,共40 个循环。以GAPDH的表达水平为标准进行相对定量,采用2-ΔΔCq法分析YY1基因的表达倍数变化。
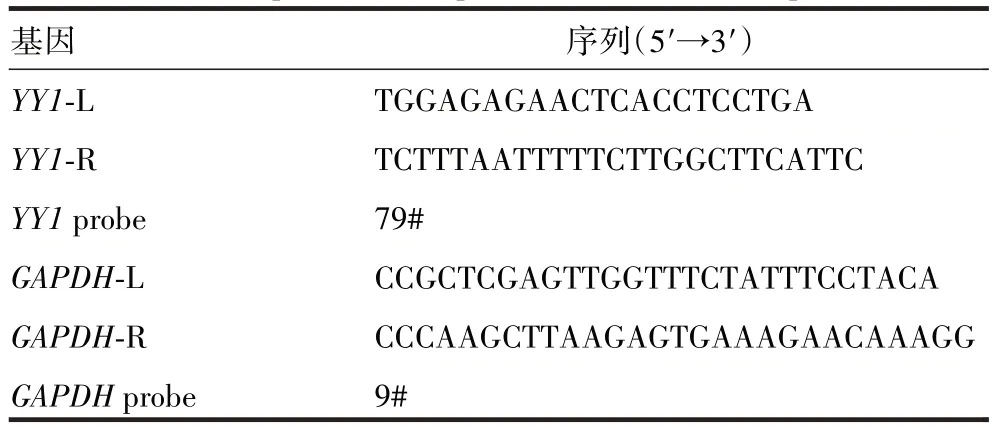
表2 RT-qPCR引物序列及探针号Tab.2 Primer sequences and probe numbers of RT-qPCR
1.8 双荧光素酶活性检测 将重组质粒和对照质粒(pGL3-Basic、pGL3-Control)分别与内参质粒 pRLCMV 共转染至293FT 细胞72 h 后,检测荧光素酶活性。用全波长酶标仪检测萤火虫萤光素酶(A560)和海肾萤光素酶(A465)活性,分析启动子不同截短片段的转录活性。
1.9 GBP5蛋白表达的检测 采用Western blot法。用LipoD293 试剂进行YY1过表达质粒转染,提前将对数生长期的293FT细胞接种至6孔板中,6×105个/孔,转染前30 ~60 min 更换为新鲜的完全培养基,转染48 h 后,提取细胞总蛋白,BCA 法定量蛋白质浓度。取等量(50 μg)蛋白,经12%SDS-PAGE分离后,转印至0.45 μm PVDF膜上,5%脱脂奶粉室温封闭2 h;
加入兔抗人GBP5、GAPDH 单克隆抗体(均1∶1 000 稀释),4 ℃孵育过夜;
TBST 洗涤3 次,加入HRP 标记的山羊抗兔IgG(1∶1 000 稀释),室温孵育2 h;
ECL 试剂盒显色,化学发光仪曝光成像。使用Image Lab 软件进行图像分析,以GAPDH为内参。
1.10 统计学分析 所有试验均独立重复3 次,计量资料以均数 ± 标准差()表示,使用 GraphPad Prism 7 软件进行统计学分析,多组与对照组的比较采用Dunnett检验和One-way ANOVA检验,两组间比较采用非配对t检验,以P<0.05 为差异有统计学意义。
2.1GBP5启动子区域转录因子结合位点预测分析通过 NCBI 数据库查询获得人GBP5(ID:115362)基因组全长序列,选取GBP5基因5′UTR 区域上游2 042 bp(-1 995 ~ +47 bp)启动子序列;
JASPAR 在线软件预测结果显示,GBP5启动子区域有多个转录因子结合位点,其中YY1、STAT1和FOXP3的预测评分排序靠前(系统评分值均大于5),见表3。

表3 JASPAR软件转录因子预测结果Tab.3 Prediction result of transcription factor by JASPAR
2.2GBP5启动子各截短片段重组质粒的鉴定GBP5启动子不同截短片段PCR 产物经1.5%琼脂糖凝胶电泳分析,分别可见2 042、1 671、1 180、567和166 bp的特异性条带,大小与预期相符,见图1。双酶切重组质粒质粒 pGL3-GBP5-11、pGL3-GBP5-21、pGL3-GBP5-31、pGL3-GBP5-41、pGL3-GBP5-51后,经1.5%琼脂糖凝胶电泳分析,各亚克隆片段大小正确,见图2。鉴定正确的质粒测序结果经BLAST 比对,插入片段与设计序列同源性达100%。以上结果表明重组质粒构建正确。

图1 GBP5启动子截短片段PCR产物电泳图Fig.1 Electrophoretic profile of PCR products of GBP5 promoter truncated fragments

图2 GBP5 启动子各片段重组质粒的双酶切(HindⅢ/XhoⅠ)鉴定Fig.2 Restriction map of recombinant plasmids of GBP5 promoter fragments(HindⅢ/XhoⅠ)
2.3GBP5启动子活性双荧光素酶活性 结果显示,GBP5启动子各质粒的荧光素酶活性均高于阴性对照组,均具有启动子活性。相比阴性对照组,质粒pGL3-GBP5-21启动子活性最高,而pGL3-GBP5-41显著降低,差异均有统计学意义(t分别为67.59和27.84,P均<0.05),见图3。表明GBP5基因核心启动子区域为 5′UTR 上游-1 623 ~ -520 bp,当截短GBP5启动子-1 061 ~ -520 bp 区域(转录因子YY1 结合位点)后,启动子活性明显降低,提示在该区域的YY1结合位点可能会显著影响GBP5启动子的活性。

图3 GBP5启动子双荧光素酶活性检测Fig.3 Double luciferase activity assay of GBP5 promoter
2.4 转录因子YY1对GBP5启动子活性的影响
2.4.1YY1过表达质粒的鉴定 PCR 扩增产物经1.5%琼脂糖凝胶电泳分析,可见1 245 bp 的特异性条带,大小与预期相符,见图4。质粒pIRES2-EGFPYY1的双酶切产物经1%琼脂糖凝胶电泳分析,可见1 245 bp 的目的基因片段和5 260 bp 的载体片段,大小均与预期相符,见图5。

图4 YY1的CDS序列PCR产物电泳图Fig.4 Electrophoretic profile of PCR product of YY1 CDS sequence

图5 质粒pIRES2-EGFP-YY1的双酶切(HindⅢ/XhoⅠ)鉴定Fig.5 Restriction map of plasmid pIRES2-EGFP-YY1(HindⅢ/XhoⅠ)
2.4.2YY1过表达质粒的鉴定 RT-qPCR 结果显示,与对照组相比,质粒pIRES2-EGFP-YY1转染组细胞YY1基因mRNA转录水平升高约20 000倍,差异有统计学意义(t=69.39,df=2,P< 0.001),表明质粒成功转染293FT 细胞并过表达目的基因。倒置荧光显微镜下观察可见明显荧光表达,见图6。表明YY1瞬时过表达质粒构建成功。

图6 质粒pIRES2-EGFP-YY1 与pIRES2-EGFP 分别转染293FT细胞48 h的荧光显微镜观察(标尺:100 μm)Fig.6 Fluorescence microscopy of plasmids pIRES2-EGFPYY1 and pIRES2-EGFP 48 h after transfection to 293FT cells respectively(Scale bar:100 μm)
2.4.3YY1过表达质粒对GBP5启动子活性及其蛋白表达的影响 双荧光素酶活性分析结果显示,与pGL3-GBP5-21组比较,过表达YY1可显著激活GBP5启动子活性,差异有统计学意义(t= 19.95,df= 2,P< 0.001),见图7。Western blot 分析显示,过表达YY1可上调GBP5 蛋白表达水平,见图8。表明YY1是调控GBP5表达的潜在转录因子。

图7 双荧光素酶活性分析过表达YY1对GBP5启动子活性的影响Fig.7 Effect of YY1 overexpression on GBP5 promoter activity analyzed by double luciferase activity

图8 Western blot 分析质粒pIRES2-EGFP-YY1 转染293FT细胞48 h GBP5蛋白表达水平Fig.8 Western blotting of GBP5 protein expression 48 h after pIRES2-EGFP-YY1 transfection to 293FT cells
GBP5 作为病原体感染激活的相关效应分子,在机体免疫应答中发挥重要的生物学作用[8]。研究报道,在弗朗西斯菌感染机体前期,GBP5 通过调控黑色素瘤缺乏因子2(absent in melanoma 2,AIM2)炎性小体的组装,增强宿主对病原菌的抵抗能力[9]。GBP5是干扰素诱导巨噬细胞活化的标志物之一[10],同时激活表达的GBP5也可参与调控干扰素通路、促进ISG的表达,从而抑制病毒的复制[11]。
GBP5基因启动子功能和特性的确定对进一步深入研究GBP5 的生物学功能具有重要意义。启动子作为基因表达的“开关”,具有调控基因表达时间及强度的功能,而转录因子则是控制“开关”的把手,调控启动子活性。YY1 属于GLI-Kruppel 锌指蛋白家族,是一种多功能转录因子,具有双重转录活性,参与调控多种基因的转录表达[12-15]。由于所处环境和结合蛋白因子的不同,YY1 在调节基因表达时既可作为抑制因子,也可作为激活因子[16-19]。已有研究发现,表皮生长因子受体(epidermal growth factor receptor,EGFR)介导Src-p38 MAPK-YY1信号通路的活化,诱导胶质瘤细胞中GBP1 的表达,促进胶质瘤细胞生长[20]。目前有关 YY1 结合GBP5启动子调控GBP5 表达的生物学活性尚未见报道。本研究通过构建GBP5启动子不同截短片段的荧光素酶报告基因重组质粒,发现GBP5核心启动子区域位于5′UTR上游-1 623 ~-520 bp,同时过表达YY1后,重组质粒荧光素酶活性明显增强,表明YY1能影响GBP5的启动子活性,提示YY1是调控GBP5表达的潜在转录因子。本研究为深入阐明GBP5基因的表达调控机制奠定了基础,也为明确GBP5的生物学功能提供了实验依据,后续将进一步探究YY1调控GBP5表达的相关信号通路。
猜你喜欢荧光素酶质粒试剂盒农药残留快速检测试剂盒的制备方法及其应用研究食品安全导刊(2021年21期)2021-08-30NNMT基因启动子双荧光素酶报告系统的构建及其与SND1靶向关系的验证天津医科大学学报(2021年4期)2021-08-21不同双荧光素酶方法对检测胃癌相关miRNAs靶向基因TIAM1的影响中日友好医院学报(2021年1期)2021-04-14重组双荧光素酶报告基因质粒psiCHECK-2-Intron构建转染及转染细胞萤火虫荧光素酶和海肾荧光素酶表达山东医药(2020年9期)2020-05-20试剂盒法制备细胞块的效果及其技术要点天津医科大学学报(2019年6期)2019-08-13短乳杆菌天然质粒分类食品科学(2018年10期)2018-05-23基于CLSI-M43国际标准改良的Mycoview-AST试剂盒检测性能评估现代检验医学杂志(2016年2期)2016-11-14重组质粒rAd-EGF构建并转染hDPSCs对其增殖的影响西南医科大学学报(2015年1期)2015-08-22Survivin-siRNA重组质粒对人神经母细胞瘤细胞SH-SY5Y的作用中国当代医药(2015年9期)2015-03-01人多巴胺D2基因启动子区—350A/G多态位点荧光素酶表达载体的构建与鉴定及活性检测中国医药导报(2015年27期)2015-02-28